
靶向编辑效率更高

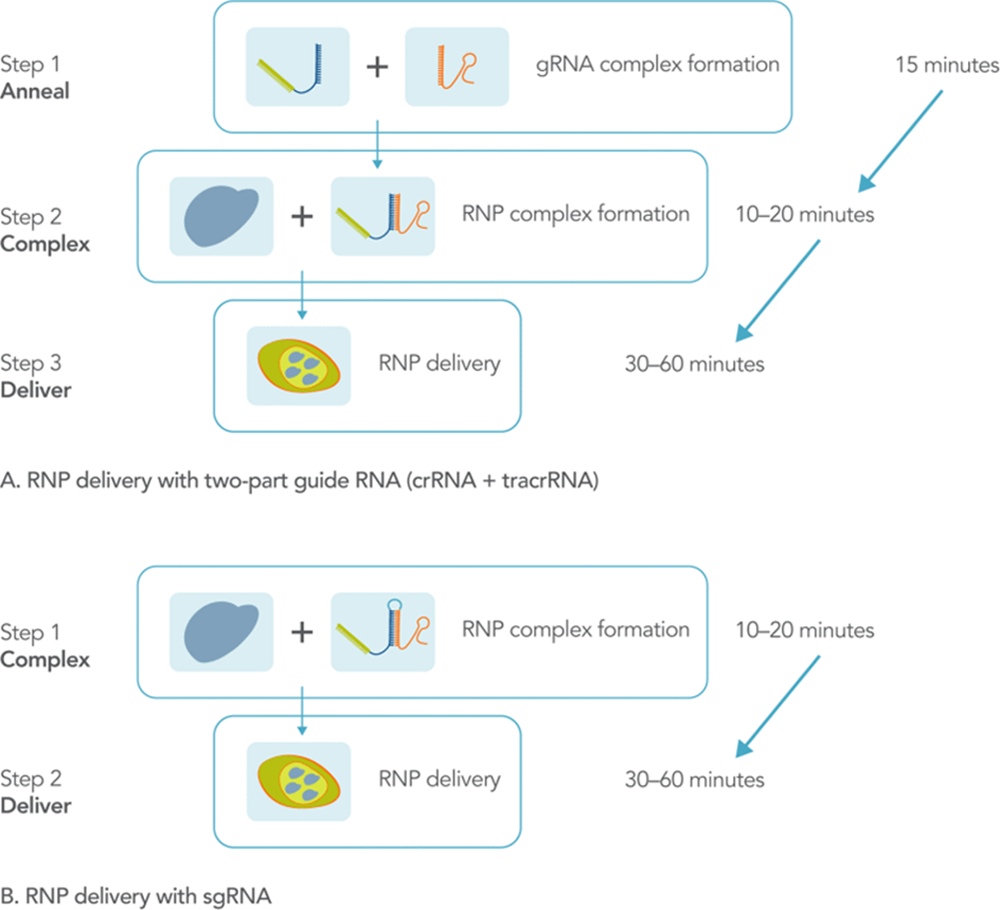
通过运送RNP提高精度控制

节省时间

减少费用
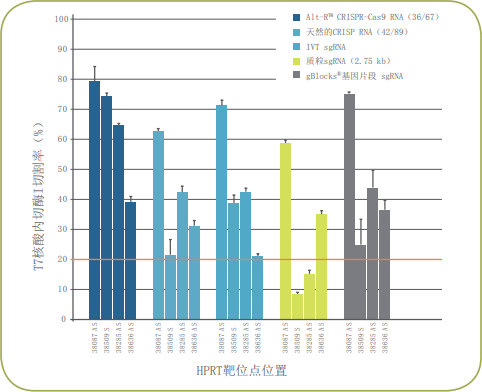
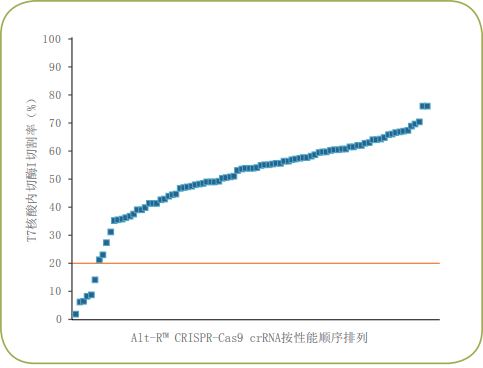
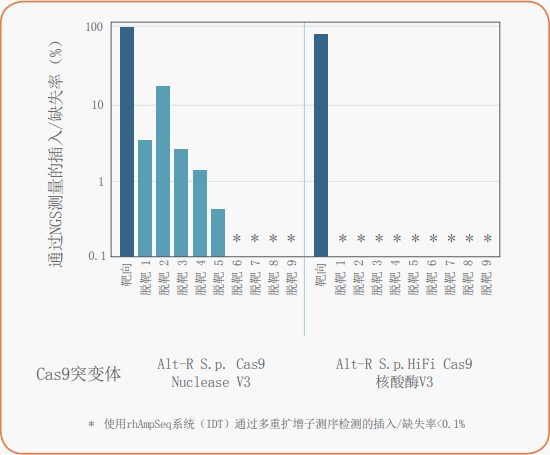
基因编辑即使在极具挑战的条件下也可以实现

通过极大降低脱靶活性来实现特异性增加与市场领先的Alt-R S.p.Cas9 Nuclease V3具有相似的高编辑效率

通过脂质体转染、电穿孔或显微注射,高效运送核糖核蛋白

可以避免通常在体外转录的Cas9 mRNA和sgRNA中观察到毒性或先天性免疫反应活性
| 产品 | 规格 | 目录号 |
| Alt-R CRISPR-Cas9 crRNA | 2、10 nmol管装 或平板装 |
订购请咨询 |
| Alt-R CRISPR-Cas9 tracrRNA | 5 nmol | 1072532 |
| 20 nmol | 1072533 | |
| 100 nmol | 107253 |
| 产品 | 规格 | 目录号 |
| Alt-R S.p. HiFi Cas9 Nuclease V3 | 100 µg | 1081060 |
| 500 µg | 1081061 |
| 产品 | 目录号 |
| Alt-R CRISPR-Cas9人类对照试剂盒(2 nmol) | 1072554 |
| Alt-R CRISPR-Cas9小鼠对照试剂盒(2 nmol) | 1072555 |
| Alt-R CRISPR-Cas9大鼠对照试剂盒(2 nmol) | 1072556 |
- • Alt-R CRISPR HPRT阳性对照 crRNA
- • Alt-R HPRT PCR Primer Mix
- • Alt-R CRISPR阴性对照 crRNA #1
- • Nuclease-Free Duplexing Buffer
- • Alt-R CRISPR-Cas9 tracrRNA
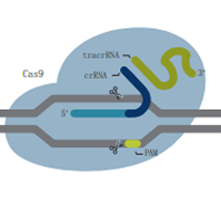
| Alt-R S.p.Cas9 核酸酶 |
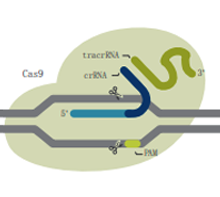
Alt-R S.p. HiFi Cas9 核酸酶 |
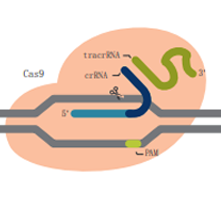
Alt-R S.p. Cas9 D10A 切口酶 |
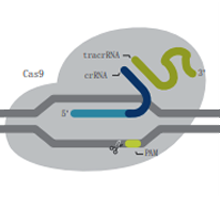
Alt-R S.p.Cas 9 H840A切口酶 |
|
 |
 |
 |
 |
|
| 描述 | 野生型Cas9酶,具有较高的基因组编辑能力,易于使用且经济实惠 | 突变的Cas9酶,在减少脱靶效应的基础上增加特异性,同时保持较高的靶向活性 | 突变的Cas9酶,在RuvC结构域中发生突变,使其缺失在非靶向链的切割能力 | 突变的Cas9酶,在HNH结构域中发生突变,使其缺失在靶向链的切割能力 |
|---|---|---|---|---|
| DNA切割 | 双链 | 双链 | 靶向链 | 非靶向链 |
| 建议用途 | 大多数CRISPR基因组编辑项目的首选 | 对于对脱靶事件敏感且需要高水平编辑效率的实验是理想之选 | 适用于同源定向修复(HDR)实验,但需要两个合适的切割位点位于彼此最佳距离内 | |
| 分子量 | 162,200 g/mol | |||
| 规格 | 100 µg或500 µg | |||
| 浓度 | 10 mg/mL(62 µM)于50%甘油中 | |||
| 运输条件 | 干冰 | |||
| 储存条件 | 在储备液中-20°C储存 | |||
| 稀释 | 使用前用Opti-MEM®培养基(Thermo Fisher)或PBS稀释 | |||
| Cas9 system | Cas12a system | |
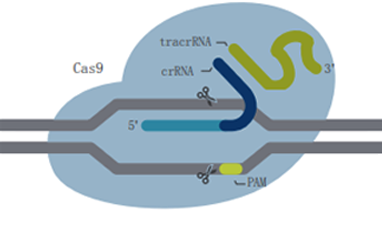 |
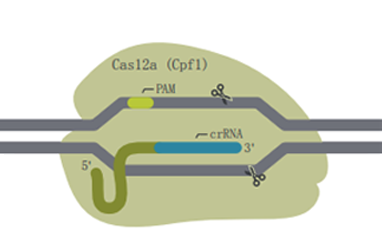 |
|
| 应用 | 一般的基因组编辑 | ●对于具有富含AT的基因组的物种 ●对于使用CRISPR-Cas9系统设计空间有限制的区域 |
|---|---|---|
| 核糖核蛋白组件 | ●gRNA选择: ●Cas9内切酶 |
●crRNA ●Cas12a内切酶 |
| Alt-R CRISPR酶 | ●野生型 ●HiFi ●切口酶(D10A和H840A) |
●野生型 ●Ultra(性能更佳) |
| Cas9 crRNA: tracrRNA(选择1) |
●crRNA ●天然:42 nt ●Alt-R:35–36 nt(推荐使用36 nt) ●天然:89 nt ●Alt-R:67 nt |
— |
| Cas9 sgRNA(选择2) | ●Alt-R:99-100 nt(推荐使用100 nt) |
— |
| Cas12a crRNA | — | ●天然:42–44 nt ●Alt-R:40-44 nt(推荐使用41 nt) |
| CRISPR酶 | ●Class 2,Cas type II ●M.W.*:162,200 g/mol ●内切酶结构域:RuvC-like和HNH |
●Class 2,Cas type V ●M.W.*:156,400 g/mol ●内切酶结构域:仅RuvC-like |
| 双链DNA切割 | ●野生型和HiFi:切割位点在前间区序列上游3个碱基的位置,形成平末端 ●D10A切口酶和配对crRNA:5’突出端 ●H840A切口酶和配对crRNA:3’突出端 ●PAM位点在基因组编辑过程中经常被破坏 |
●切割位点在前间区序列的5’端,形成5’突出端 ●PAM位点在基因组编辑后可能会继续存在 |
| PAM序列† | NGG | ●对于Cas12a V3,TTTV ●对于Cas12a Ultra,TTTN |
| 建议运送Alt-R RNP的方法 |
●使用/不使用Alt-R enhancer, 通过电穿孔运送 ●显微注射 ●脂质体转染 |
●使用Alt-R enhancer,通过电穿孔运送 ●显微注射 |
† N = 任意碱基;V = A、C、或G
(图1)

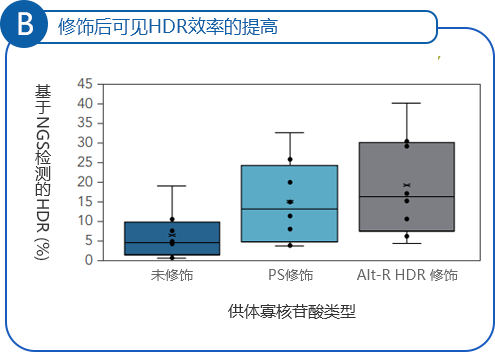
(图2)
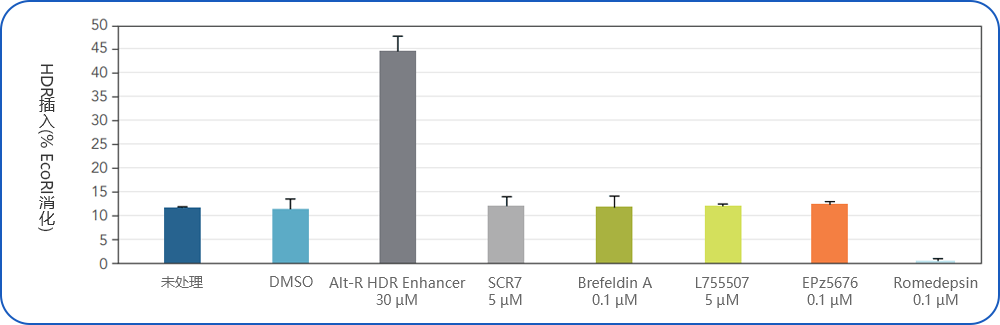
(图3)
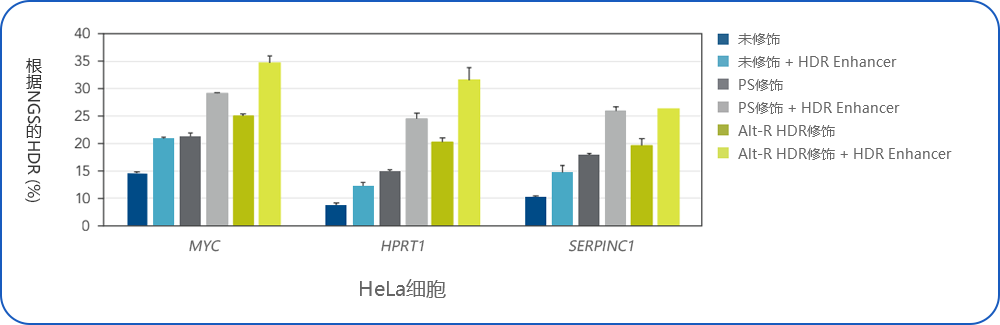
1. Vakulskas CA, Dever DP, et al. (2018) A high-fidelity Cas9 mutant deliverd as a ribonucleoproteincomlex enables efficient gene editing in human hematopoietic sten and progenitor cells. Nat Med. 24:1216–1224. doi: 10.1038/s41591-018-0137-0.
2. Park SH, Lee CM, et al. (2018)rived Highly effocent editing of the beta-globin gene in patient de hematopoietic stem and progenitor cells to treat sickle cell disease. Blood, 132(Suppl 1),2192. doi: 10.1182/blood-2018-99-117371.
美国Integrated DNA Technologies公司(以下简称IDT)创办于1987年,是寡核苷酸合成领域的领导者,在过去的30多年里IDT致力于为学术研究、农业发展、医疗诊断、药物研发等领域开发和制造核酸产品,IDT可以为客户提供高品质的产品、专业的技术支持和个性化的定制服务。在分子生物学领域,IDT为二代测序、基因编辑、qPCR和RNA干扰等领域开发了一系列专有技术。IDT生产的GMP级别产品被广泛应用于多种癌症以及遗传和感染性疾病的诊断试剂研发,并通过不断优化自动化合成平台的处理技术来加快原研试剂的开发和生产。
IDT为100多个国家和地区的超过120,000名生命科学研究人员提供服务,每天生产70,000多条核酸产品。IDT针对基因组学应用开发的创新工具和解决方案正在打破研究壁垒,激发您的梦想,实现下一个突破。

